Estaño:
Nombre
|
Estaño
|
Número atómico
|
50
|
Valencia
|
2,4
|
Estado de oxidación
|
+4
|
Electronegatividad
|
1,8
|
Radio covalente (Å)
|
1,41
|
Radio iónico (Å)
|
0,71
|
Radio atómico(Å)
|
1,62
|
Configuración electrónica
|
[Kr]4d105s25p2
|
Primer potencial de ionización (eV)
|
7,37
|
Masa atómica (g/mol)
|
118,69
|
Punto de ebullición (ºC)
|
2270
|
Punto de fusión (ºC)
|
231,9
|
Descubridores
|
Los antiguos
|
CARACTERÍSTICAS
· Color muy brillante, aunque a temperatura ambiente se oxida y pierde brillo exterior.
· A temperatura ambiente es muy maleable . En cambio en caliente es frágil y quebradizo.
· Por debajo de -18ºC se descompone y se transforma en polvo. (Peste del estaño)
Las principales aleaciones son:
· Bronce: Aleación de cobre y estaño
· Soldaduras blandas: Aleaciones de plomo y estaño con proporciones entre el 25 y el 90%.
Las aleaciones bajo punto de fusión más importantes son:
· Darcet: (25% Sn + 25% Pb + 50% Bi) Funde a 97ºC.
· Cerrolow: (8,3% Sn + 22,6% Pb + 44,7% Bi + 5,3% Cd + 19,1% In) Funde a 47ºC.
Una de las aplicaciones más importantes del estaño la fabricación de hojalata. Consiste en recubrir una chapa de acero de dos capas de acero con dos capas muy finas de estaño puro. El estaño protege al acero contra la oxidación.
Cobre:
Los minerales de cobre más utilizados en la actualidad se encuentran en forma de:
Cobre nativo
|
Sulfuros
|
Óxidos
|
|
Calcopirita
|
Malaquita
| |
Cobre nativo
|
Calcosina
|
Cuprita
|
CARACTERÍSTICAS
· Es muy dúctil (se obtienen hilos muy finos) y maleables (pueden formarse láminas hasta de 0,02 mm de espesor).
· Posee una alta conductividad eléctrica (capacidad de un material para conducir corriente eléctrica, dejando circular libremente cargas eléctricas gracias a que dentro de su estructura hay muchos electrones con vínculos débiles que permiten el movimiento de las partículas) y conductividad térmica (magnitud que posee un material para conducir calor).
· Es duro a temperatura ambiente y temperaturas frías; presenta resistencia a distintas alteraciones físicas, tales como a ser cortado, golpeado o al recibir fuerzas de tracción y empuje.
Diferentes métodos de obtención del cobre:
· Proceso de obtención por vía seca: se utiliza cuando el contenido de cobre supera el 10%. Las fases de este proceso son las siguientes:
1) Introducción en la trituradora o machacadora.
2) Molienda en molino de bolas.
3) Separación de la ganga: se introduce el mineral en polvo en un depósito lleno de agua y se agita. El mineral, más pesado, se irá al fondo, mientras que la ganga flotará y se sacará por arriba.
4) Oxidación parcial del mineral en horno: el objetivo es oxidar el hierro presente, pero no el cobre. Actualmente se suele colocar en una cinta transportadora metálica que se mueve lentamente al mismo tiempo que se calienta la mena. de esta manera se consigue separar el hierro del cobre.
5) Fundición en horno de reverbero: Fundente (sílice y cal) que reacciona con el azufre y el óxido de hierro, formando la escoria.
7) Refinado electrolítico en la cuba: Cobre 99,5%
La adición al cobre de otros metales no ferrosos mejora sus propiedades mecáicas y de resistencia a la oxidación. Las aleaciones más usadas son:
ALEACIÓN
|
TIPOS/COMPOSICIÓN
|
ALGUNAS APLICACIONES
|
Bronce (aleación de cobre y estaño)
|
Ordinario. Solo lleva cobre y estaño
Especial. Lleva cobre, estaño y otros elementos químicos.
|
|
Latón (aleación de cobre y cinc)
|
Ordinario. Solo lleva cobre y cinc.
Especial. Lleva cobre, cinc y otros elementos químicos.
|
|
Cuproaluminio
|
Aleación de cobre y aluminio.
|
|
Alpaca
|
Aleación de cobre, níquel y cinc.
|
|
Cuproníquel
|
Aleación de cobre y níquel.
|
|
Cinc:
Número atómico
|
30
| |
Valencia
|
2
| |
Estado de oxidación
|
+2
| |
Electronegatividad
|
1,6
| |
Radio covalente (Å)
|
1,31
| |
Radio iónico (Å)
|
0,74
| |
Radio atómico (Å)
|
1,38
| |
Configuración electrónica
|
[Ar]3d104s2
| |
Primer potencial
de ionización (eV) |
9,42
| |
Masa atómica (g/mol)
|
65,37
| |
Densidad (g/ml)
|
7,14
| |
Punto de ebullición (ºC)
|
906
| |
Punto de fusión (ºC)
|
419,5
| |
Descubridor
|
Andreas Marggraf en 1746
| |
Es un metal de color blanco y azulado que arde en el aire con llama verde azulada. El aire seco no le ataca pero en presencia de humedad se forma una capa superficial de óxido o carbonato básico que aisla al metal y lo protege de la corrosión.
CARACTERÍSTICAS
- Muy resistente a la oxidación y corrosión en el aire y en el agua, pero poco resistente al ataque de ácidos y sales.
- Tiene el mayor coeficiente de dilatación térmica de todos los metales.
- A temperatura ambiente es quebradizo, pero entre 100 y 150°C es muy maleable.
- Tiene propiedades superplásticas y a 238°C obtiene propiedades ferromagnéticas.
Proceso de obtención
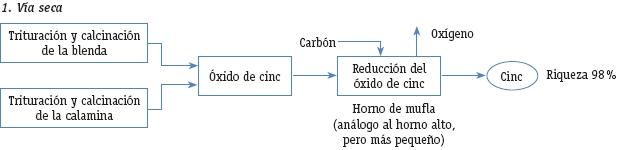
Dependiendo de la concentración del mineral de cinc se emplean dos procedimientos de obtención: vía seca (concentraciones superiores al 10%) y vía húmeda (concentraciones inferiores al 10%).
Las presentaciones comerciales del cinc más usuales son:
- En forma de aleación:
-Latones: por ser más barato el cinc que el estaño, en muchas aplicaciones el latón está sustituyendo al bronce.
-Plata alemana o alpaca (Cu + Ni + Zn): Utilizada antiguamente en cubertería. En la actualidad se utiliza en joyería barata y fabricación de estuches.
-Zamak (Al + Cu + Zn): Se emplea para la obtención de piezas de gran precisión t de gran calidad superficial, con lo que no necesitan mecanizado.
- En estado puro:
-En forma de chapas de diferentes espesores:
-Recubrimiento de tejados.
-Canalones y cornisas.
-Recubrimiento de pilas.
- Como recubrimiento de piezas:
-Galvanizado electrolítico: recubrir mediante electrólisis un metal con una capa muy fina de cinc, 15ml de diámetro.
-Galvanizado en caliente: la pieza se introduce en un baño de cinc fundido. Una vez enfriada, el cinc queda adherido y la pieza protegida.
-Metalizado: se proyectan partículas diminutas de cinc, mezcladas con pintura, sobre la superficie a proteger.
-Sherardización: consiste en recubrir con polvo de cinc una pieza de acero e introducirla en un horno. Por el calor, el cinc penetra en el acero.
- Otras formas:
-Óxidos de cinc:
-Bronceadores, desodorantes.
-Colorantes, pegamentos.
Nombre
|
Cobre
|
Número atómico
|
29
|
Valencia
|
1,2
|
Estado de oxidación
|
+2
|
Electronegatividad
|
1,9
|
Radio covalente (Å)
|
1,38
|
Radio iónico (Å)
|
0,69
|
Radio atómico (Å)
|
1,28
|
Configuración electrónica
|
[Ar]3d104s1
|
Primer potencial de ionización (eV)
|
7,77
|
Masa atómica (g/mol)
|
63,54
|
Densidad (g/ml)
|
8,96
|
Punto de ebullición (ºC)
|
2595
|
Punto de fusión (ºC)
|
1083
|
Descubridor
|
Los antiguos
|
Plomo:
Nombre
|
Plomo
|
Número atómico
|
82
|
Valencia
|
2,4
|
Estado de oxidación
|
+2
|
Electronegatividad
|
1,9
|
Radio covalente (Å)
|
1,47
|
Radio iónico (Å)
|
1,2
|
Radio atómico (Å)
|
1,75
|
Configuración electrónica
|
[Xe]4f145d106s26p2
|
Primer potencial de ionización (eV)
|
7,46
|
Masa atómica (g/mol)
|
207,19
|
Densidad (g/ml)
|
11,4
|
Punto de ebullición (ºC)
|
1725
|
Punto de fusión (ºC)
|
327,4
|
Descubridor
|
Los antiguos
|
CARACTERÍSTICAS
- Es muy maleable y blando.
- Color grisáceo-blanco muy brillante recién cortado pero se oxida con facilidad.
- Resiste los ácidos clorhídrico y sulfúrico, pero es atacado por el ácido nítrico y por el vapor de azufre.
APLICACIONES
- En estado puro:
- Óxido de plomo: Usado para fabricar pinturas al minio.
- Tuberías: Aunque está en desuso.
- Recubrimiento de baterías, protección de radiaciones…
- Soldaduras.
- En aleaciones:
- Soldadura blanda: (Plomo y estaño) Empleado como material de aportación (se utiliza para la realización de un cordón de soldadura de buena calidad)
Proceso de obtención
- Enriquecimiento: Galena se tritura y muele. Se separa la ganga de la mena mediante flotación (separación de especies minerales mediante la adhesión selectiva de partículas minerales a burbujas de aire).
- Oxidación de los sulfuros: Se tostan los sulfuros de Pb para transformarlos en óxidos. Se añade sílice y cal y se obtiene monóxido de plomo (PbO).
- Reducción del monóxido de Pb: Se realiza en un horno de mufla (horno alto y pequeño). Se usa carbón coque y cal. Este plomo tiene muchas impurezas y se denomina “plomo de obra”.
- Afinado de plomo: Consta de dos fases:
- Separación: (Generalmente magnética) En ella se separa de otros metales como el cobre, zinc o plata.
- Afinado electrolítico: La electrólisis de soluciones acuosas o sal se funde y producen metales de alta pureza.
METAL
|
CARACTERÍSTICAS Y APLICACIONES
|
PROPIEDADES
|
CROMO
|
CARACTERÍSTICAS
APLICACIONES
|
1900° C
6,8 kg/dm3
Ωmm2/m
|
NÍQUEL
|
CARACTERÍSTICAS
APLICACIONES
|
Ωmm2/m
|
WOLFRAMIO O TUNGSTENO
|
CARACTERÍSTICAS
APLICACIONES
|
|
COBALTO
|
CARACTERÍSTICAS
APLICACIONES
|
Ωmm2/m
|















No hay comentarios:
Publicar un comentario